血液裂红后的流式图VS经样本密度分离液分离后的流式图:
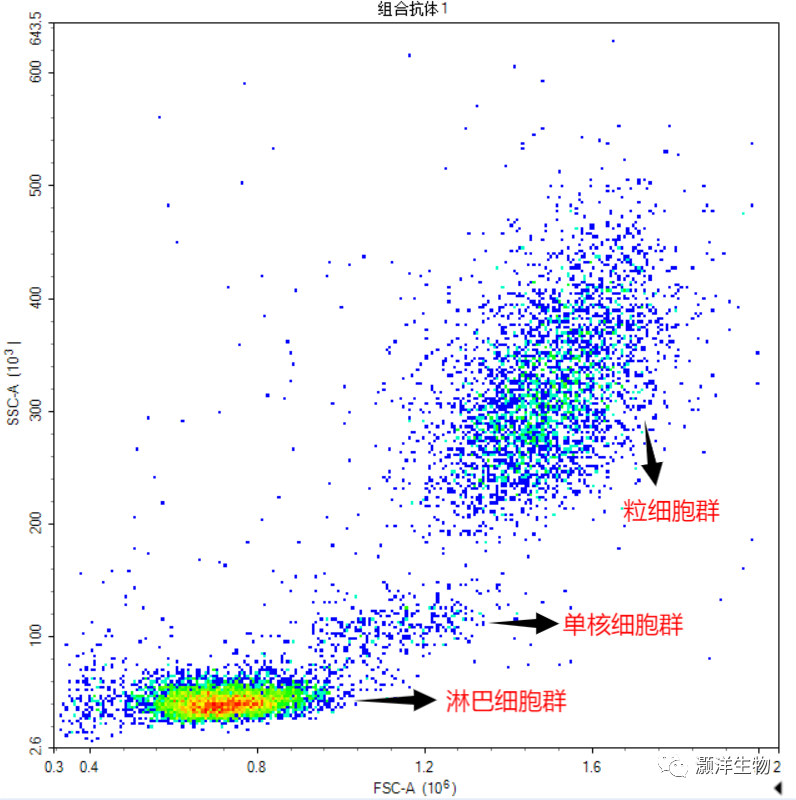
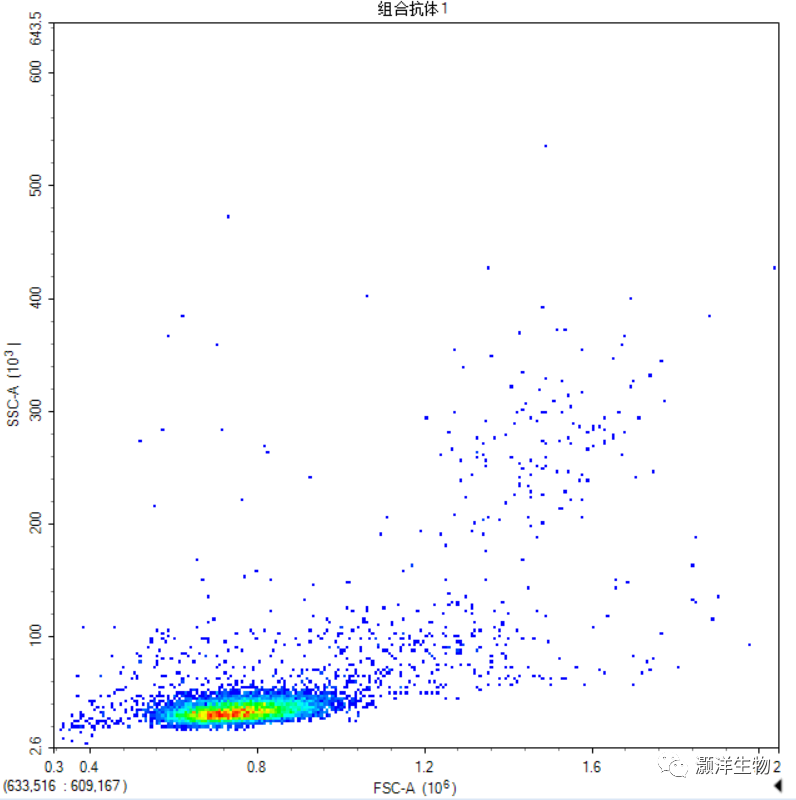
血液中单个核细胞的分离要点:
一.抗凝剂的选择
1.分离出的PBMC需要进行下一步细胞培养(如培养NK、CIK细胞):选择肝素抗凝剂。由于血浆中的纤维蛋白原活化成有活性的纤维蛋白,纤维蛋白交联成纤维蛋白血凝块,易使PBMC形成细胞团块,不利于细胞的活化。肝素钠抗凝剂可减轻上述情况发生几率。
2.分离出的PBMC无需培养,而是用于其他检测:选择枸橼酸钠抗凝剂,分离效果最佳。
二.对血液的要求
PBMC最佳分离时间为血液离体后2小时内。如达不到2小时内分血条件,请务必于4小时内进行分血步骤,超过4小时很难顺利进行分离。
血液离体时间 | 分离效果 |
2小时内 | 最佳 |
2-4小时 | 可接受 |
4-6小时 | 细胞活性下降,分离效果不佳 |
6小时以上 | 分离效果极差,直至分离不出细胞 |
三.分离液的使用环境
1.分离液需常温(37℃-15℃)避光保存,严禁冷藏冷冻保存;
2.使用时严格遵守无菌操作规范,并在18℃-22℃环境温度下进行操作,20℃条件下分离效果最佳。超出此温度范围,有可能使分离液密度发生改变,造成分离效果不佳。
四.血液样本稀释方法
1.稀释方法:1份的PBS或生理盐水加2份的血液进行稀释(PBS:抗凝血=1:2);
2.稀释液要求:用不含钙镁离子的缓冲液或培养基进行血液稀释。
五.各种规格离心管的使用方法
1.15ml离心管(包括高效离心管):
1)最佳比例:5ml分离液 + 4ml稀释过的血液
2)最佳离心条件:20℃环境下,500g离心25min
3)离心机使用时调整为慢升慢降(具体参数请咨询离心机厂家)
建议升速(指开始启动→达到设定离心力)的时间、降速(指设定离心时间完成→机器完全停止)时间均控制在3分钟左右。
2.50ml离心管(包括高效离心管):
1)最佳比例:20ml分离液 + 20ml稀释过的血液
2)最佳离心条件:20℃环境下,650g离心30min
3)离心机使用时调整为慢升慢降(具体参数请咨询离心机厂家)
建议升速(指开始启动→达到设定离心力)的时间、降速(指设定离心时间完成→机器完全停止)时间均控制在3分钟左右。
3.未经稀释的抗凝血分离方法(细胞培养、或需保存血浆推荐用此方法):
使用50ml离心管(或50ml高效离心管)
1)50ml普通离心管最佳比例:20ml分离液 + 20ml抗凝血;
50ml高效离心管最佳比例:15ml分离液 + 20ml抗凝血;
2)最佳离心条件:20℃环境下,600g离心30min;
3)获得纯度较高的血浆:离心后,吸取血浆层由上至下的2/3处血浆,下1/3处血浆可能包含部分PBMC及少量分离液成分。
使用15ml离心管(或15ml高效离心管)
1)15ml普通离心管最佳比例:5ml分离液 + 5ml抗凝血;
15ml高效离心管最佳比例:4ml分离液 + 5ml抗凝血;
2)最佳离心条件:20℃环境下,600g离心25min;
3)获得纯度较高的血浆:离心后,吸取血浆层由上至下的2/3处血浆,下1/3处血浆可能包含部分PBMC及少量分离液成分;
4)若采血量较少,需小量分离,分离液的量不得少于3ml,抗凝血量在0.2-3ml之间。
转自:https://mp.weixin.qq.com/s/SvYm5neIZip_7HgN-f-KHw

 手机/微信
手机/微信