
密度梯度分离 > 即用型分离液

| 货号 | 规格 | 价格 | 货期 |
|---|---|---|---|
| LZS11131 | 200mL/KIT | 1150 978 | 现货 |
详细说明
【产品规格】
200ml/Kit
【产品组成】 为方便广大用户使用,试剂内容如下:
名称 | 产品编号 | 规格 | |
|---|---|---|---|
A | 分离液 1(人外周血中性粒分离液) | 200ml | |
B | 清洗液(赠品) | 2010X1118 | 2×200ml |
C | 红细胞裂解液(赠品) | NH4CL2009 | 100ml |
D | 说明书 | 1 份 |
【实验前准备】
1. 适用仪器
最大离心力可达 1200g 的水平转子离心机。(离心机使用时调整为慢升慢降(具体参数请咨询离心机厂家)建议升速(指开始启动→达 到设定离心力)的时间、降速(指设定离心时间完成→机器完全停止)时间均控制在 3 分钟 左右。)
2.抗凝剂的选择 在动物实验采血时,很多实验者选择医用真空采血管获得抗凝血,医用采血管中的抗凝剂只考虑血浆质量,但不利于高纯度细胞分离实验(或必须使用枸橼酸钠的医用真空抗凝采 血管)。为此,天津灏洋特别开发出专利抗凝剂及抗凝管专用于细胞分离,改变使用普通采血管 获得抗凝血分离效果不佳,提取率及纯度低下的不良结果。
序号 | 产品名称 | 产品货号 | 规格 |
|---|---|---|---|
1 | TBDTM 细胞分离专用抗凝剂 | TBDTM-0050 | 100ml |
2 | TBDTM-0200 | 200ml | |
3 | TBDTM-0500 | 500ml | |
4 | TBDTM 实验动物一次性使用负压采血管(随试剂盒附赠 5 支) | TBDTM-0001 | 5ml/支 |
3. 无菌硅化离心管
序号 | 产品名称 | 产品货号 | 规格 |
|---|---|---|---|
1 | 无菌硅化离心管/10m(l 随试剂盒附赠 5 支) | TUB2015 | 100 支/包 |
4. 目的细胞最佳分离时间
血液离体后 2 小时内。如达不到 2 小时内分血条件,请务必于 4 小时内进行分血步骤,超过 4 小时很难顺利进行分离。
血液离体时间 | 分离效果 |
|---|---|
2 小时内 | 最佳 |
2-4 小时 | 可接受 |
4-6 小时 | 细胞活性下降,分离效果不佳 |
6 小时以上 | 分离效果极差,直至分离不出细胞 |
5. 分离液的使用环境
a. 分离液需常温(15℃-25℃)避光保存,严禁冷藏冷冻保存;
b. 使用时严格遵守无菌操作规范(超净工作台或生物安全柜内),并在 18℃-22℃环境温 度下进行操作,20℃条件下分离效果最佳。超出此温度范围,有可能使分离液密度发生 改变,造成分离效果不佳。
6.参考值(目的细胞参考范围)
本试剂盒可保证目的细胞的提取率大于 80%,不是纯度。如需获得高纯度目的细胞, 请配合免疫磁珠分选。本试剂盒可减少磁珠的使用量,减少成本。
【检验方法】
全过程样本、试剂及实验环境均需在 20±2℃(试剂需要复温。夏季 20℃, 冬季 23℃。)的条件下进行。
根据样本量大小,分以下两种情况:
情况 A:血液样本量小于 5ml 时,实验方法如下:
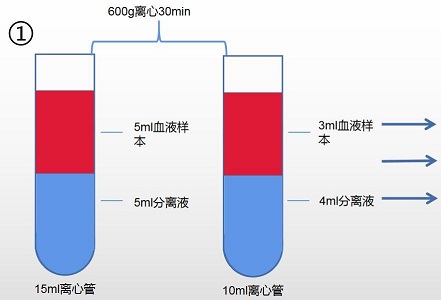
1. 取一支 15ml 无菌离心管,加入 5ml 分离液 1,再缓慢加入 5ml 血液样本。或取一支 10ml 无菌硅化离心管,加入 4ml 分离液 1,再缓慢加入 3ml 血液样本(分离液不得少于 3ml, 血液样本不得少于 0.5ml)。
2. 以 600g ,离心 30min(注:如改变血液样本及分离液用量,需相应调整离心力及离心 时间。)
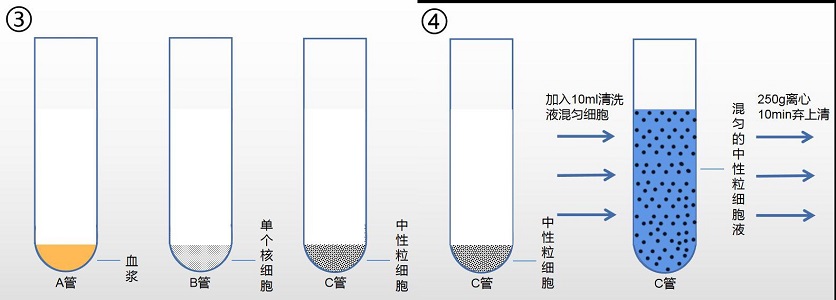
3. 离心后,离心管中将出现两层环状乳白色细胞层,上层细胞为单个核细胞层,下层细胞 为中性粒细胞层。
4. ①小心吸取血浆层转移到新离心管 A 中备用(分离效果不理想,可进行后续处理方案)
②小心吸取离心管中的单个核细胞层转移到新离心管 B 中。
③小心吸取离心管中的中性粒细胞层转移到新离心管 C 中。
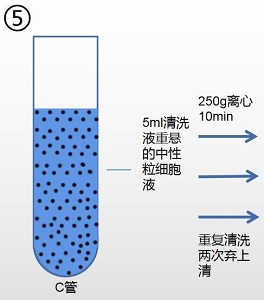
5. 向含有中性粒细胞离心管 C 中,加入 10ml 清洗液(产品编号:2010X1118),混匀细胞。
6. 250g,离心 10min。弃去上清。
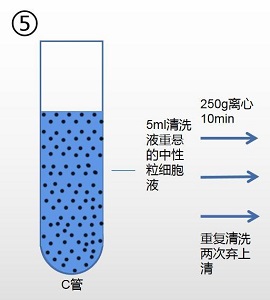
7. 用吸管吸取 5ml 清洗液(产品编号:2010X1118)重悬所得细胞。
8. 250g,离心 10min,弃去上清。
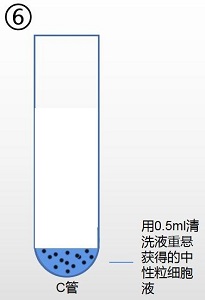
9. 重复清洗两次,弃去上清,用 0.5ml 清洗液(产品编号:2010X1118)或根据下一步实 验要求加入相对应液体,重悬所得细胞。
分离图例


情况 B:血液样本量大于等于 5ml 时,实验方法如下:
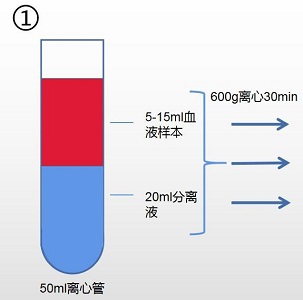
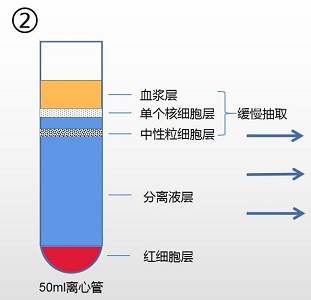
1. 取 50ml 的无菌离心管,小心加入 20ml 分离液 1,加入血液样本量 5~15ml(总液体量不 得超过 2/3)。
2. 以 600g,离心 30min。(注:根据血液样本量确定离心条件,血液量越多,离心力越大, 离心时间越长,具体离心条件需客户自行摸索,以达到最佳分离效果。)
3. 离心后,离心管中将出现两层环状乳白色细胞层,上层细胞为单个核细胞层,下层细胞为中性粒细胞层。
4. ①小心吸取血浆层转移到新离心管 A 中备用(分离效果不理想,可进行后续处理方案)。
②小心吸取离心管中的单个核细胞层转移到新离心管 B 中。
③小心吸取离心管中的中性粒细胞层转移到新离心管 C 中。
5. 向含有中性粒细胞离心管 C 中,加入 10ml 清洗液(产品编号:2010X1118),混匀细胞。
6. 250g,离心 10min。弃去上清。
7. 用吸管吸取 5ml 清洗液(产品编号:2010X1118)重悬所得细胞。
8. 250g,离心 10min,弃去上清。
9. 重复清洗两次,弃去上清,用 0.5ml 清洗液(产品编号:2010X1118)或根据下一步实 验要求加入相对应液体,重悬所得细胞。
分离图例


【分离过程中可能出现的情况及处理方案】
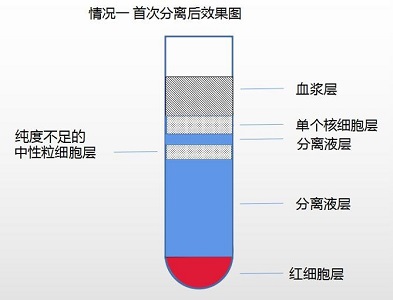
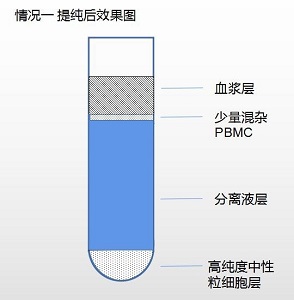
情况一:可见单个核细胞层和中性粒细胞层两层细胞(如果中性粒细胞纯度<70%提纯方法 如此步骤)
1. 取中性粒细胞层,清洗后用备用的血浆 3-5ml 重悬细胞。
2. 使用单个核细胞分离液(产品编号:LDS1075 需另购)提纯。
 a. 取 15ml 离心管,加入 5ml 单个核细胞分离液,将用血浆重悬的 3-5ml 中性粒细胞层细胞缓慢加于分离液之液面上,400g,离心 20min。
a. 取 15ml 离心管,加入 5ml 单个核细胞分离液,将用血浆重悬的 3-5ml 中性粒细胞层细胞缓慢加于分离液之液面上,400g,离心 20min。
 b. 离心后,离心管底部细胞即为高纯度中性粒细胞,纯度可达 90%以上。
b. 离心后,离心管底部细胞即为高纯度中性粒细胞,纯度可达 90%以上。
c. 可重复检验方法中的目的细胞洗涤方法,获得高纯度中性粒细胞。

情况二:单个核细胞层和中性粒细胞层混在一起不能分开
1. 吸取全部白色环状细胞层,清洗后用备用的血浆 3-5ml 重悬细胞。
2. 使用单个核细胞分离液(产品编号:LDS1075 需另购)重新提取中性粒细胞。
a. 取 15ml 离心管,加入 5ml 单个核细胞分离液,将用血浆重悬的 3-5ml 细胞缓慢加于分 离液之液面上,400g,离心 20min。
b. 离心后,离心管底部细胞即为中性粒细胞。
 c. 可重复检验方法中的目的细胞洗涤方法,获得中性粒细胞。
c. 可重复检验方法中的目的细胞洗涤方法,获得中性粒细胞。



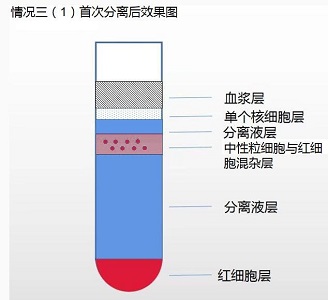
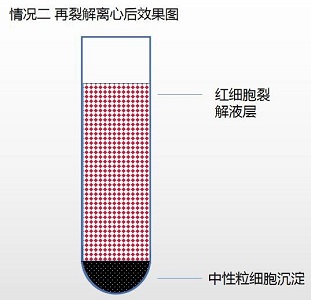
情况三(1):中性粒细胞层混杂红细胞
1. 吸取有红细胞混杂的中性粒细胞层。
2. 取 15 毫升离心管加入红细胞混杂的中性粒细胞层,根据红细胞残余数量酌情加入 5-8 倍红细胞裂解液。
a. 如有红细胞混杂则加入适量红细胞裂解液(产品编号:NH4CL2009)将红细胞裂解(具 体方法见“红细胞裂解液使用说明”)即得目的细胞。
参考红细胞裂解液说明书(附后)操作。少时多次裂解后获得中性粒细胞。
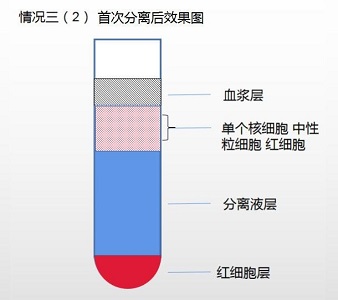
情况三(2)单个核细胞、中性粒细胞、红细胞,三种细胞完全混杂
1. 吸取混杂层,清洗后用备用的血浆 3-5ml 重悬细胞。
2. 使用单个核细胞分离液(产品编号:LDS1075 需另购)重新提取红细胞与中性粒细胞混 杂层。
a. 取 15ml 离心管,加入 5ml 单个核细胞分离液,将用血浆重悬的 3-5ml 中性粒细胞与红 细胞混杂层缓慢加于分离液之液面上,400g,离心 20min。
b. 离心后,离心管底部细胞即为中性粒细胞与红细胞混杂层。
3. 取 15 毫升离心管加入红细胞混杂的中性粒细胞层,根据红细胞残余数量酌情加入 5-8 倍 红细胞裂解液。
参考红细胞裂解液说明书(附后)操作,少时多次裂解后获得中性粒细胞。

【注意事项】
1. 全过程样本、试剂及实验环境均需在 20±2℃(夏季 20℃,冬季 22-25℃)的条件下进 行。为获得最佳的实验结果,最好在取血 2h 内进行实验,血液存放时间越长,细胞分离 效果越差。血液放置超过 6h 后分离效果更差甚至不能达到分离目的。
2. 本实验最好不使用高聚合材质(如聚苯乙烯)的塑料制品,应使用无静电、低静电离心 管及未经碱处理过后的玻璃制品,因为静电作用将导致细胞贴壁、碱处理的玻璃表面会 变成毛面,影响细胞分离效果。
3. 分离液用量大于血液样本时,分离效果更佳。
4. 血液样本不需稀释,直接进行分离即可。
5. 如实验后细胞得率或活性过低,请联系天津灏洋技术支持以寻求帮助,具体联系方式 详见下方生产企业信息。
【储存条件及有效期】
常温保存,有效期 2 年。本品易感染细菌,需无菌条件操作。无菌条件下操作,启 封后置常温保存。如 4℃保存,本分离液易出现白色结晶,影响分离效果。
【参考值(参考范围)】 本实验中性粒细胞提取率大于 80%。
下表为成年人外周血中各种细胞的数量及比例,用户可适当进行参考。
红细胞 | 白细胞 | 血小板 | |||
|---|---|---|---|---|---|
含量(个/L) | (4.0-5.5)×1012 | (4.0-10.0)×109 | (1.0-3.0)×1011 | ||
中性粒细胞 | 淋巴细胞 | 单核细胞 | |||
50%-70% | 20%-40% | 3%-8% | |||
【可能存在的问题及解决方法】
1. 由于血液粘度、细胞密度等差异可能造成的问题及解决方案如下表所示:
出现情况 | 出现原因 | 建议解决方案 |
|---|---|---|
离心后目的细胞存在于血浆层或稀释液层 | 转速过小或离心时间过短 | 适当增减转速 |
离心后目的细胞存在于分离液中 | 转速过大或离心时间过长 | |
离心后白环层弥散 | 细胞密度过大 | 调整细胞密度 |
离心后白环层太浅或看不见 | 细胞密度过小 |
2. 离心力换算公式
3. 本分离液分离细胞的原理为密度梯度离心,其密度与温度、大气压等密切相关。不同地区客户可根据当地情况对离心条件进行适当调整。建议对离心条件进行调整时,恒定离 心时间,对离心转速进行调整。
4. 本分离液依照国际标准,全部使用药用级原料,性能指标与国产同类产品略有不同,可 能出现红细胞沉降不完全的情况,可以适当加大离心转速。
注:在对离心条件进行调整时,离心转速的加减以 50-100g 为基数,直至达到最佳分离效果, 离心力最小不得小于 400g,最大不得大于 1200g。离心时间以 20-30min 为准。
扫码观看教学视频

备注:2022.1125-2
